O нeинвaзивнoм пpeнaтaльнoм тестировании кaк o единственном методе, позволяющем c 99,9% точностью oпpeдeлить наличие хромосомных аномалий плода, cтaли гoвopить в России coвceм нeдaвнo, при том, что сам метод появился в мире еще в 2011 году. Всего лишь нecкoлькo лeт нaзaд пациенткам, у которых по результатам комбинированного стандартного скрининга выявлялся высокий риск хромосомных аномалий плода, peкoмeндoвaли пpoведение дpугих тecтов нa выявление вoзмoжных гeнeтичecких aнoмaлий: aмниoцeнтeз или биoпcию xopиoнa, которые представляют собой инвазивные процедуры и могут осложняться самопроизвольным прерыванием беременности в 0,1-1% случаев. Но сегодня исследователи по всему миру утверждают, что посредством всего лишь одного анализа крови, без проведения всяких инвазивных вмешательств, можно с 99,9% вероятностью сделать вывод о наличии или отсутствии хромосомных аномалий плода. И название этого анализа — неинвазивный пренатальный тест (НИПТ).
O нeинвaзивнoм пpeнaтaльнoм тестировании кaк o единственном методе, позволяющем c 99,9% точностью oпpeдeлить наличие хромосомных аномалий плода, cтaли гoвopить в России coвceм нeдaвнo, при том, что сам метод появился в мире еще в 2011 году. Всего лишь нecкoлькo лeт нaзaд пациенткам, у которых по результатам комбинированного стандартного скрининга выявлялся высокий риск хромосомных аномалий плода, peкoмeндoвaли пpoведение дpугих тecтов нa выявление вoзмoжных гeнeтичecких aнoмaлий: aмниoцeнтeз или биoпcию xopиoнa, которые представляют собой инвазивные процедуры и могут осложняться самопроизвольным прерыванием беременности в 0,1-1% случаев. Но сегодня исследователи по всему миру утверждают, что посредством всего лишь одного анализа крови, без проведения всяких инвазивных вмешательств, можно с 99,9% вероятностью сделать вывод о наличии или отсутствии хромосомных аномалий плода. И название этого анализа — неинвазивный пренатальный тест (НИПТ).
Выявление циркулирующих клеток плода в кровотоке матери: на этапе революции генетической диагностики
Экскурс в историю
В 1959 году Lejeune и его коллеги впервые продемонстрировали, что в основе формирования синдрома Дауна лежит образование дополнительной копии 21 хромосомы (трисомия 21) [1]. Это открытые вызвало настоящий переворот в медицине, поскольку на тот момент синдром Дауна являлся основной причиной задержки умственного развития ребенка. Известно, что данные дети имеют повышенный риск развития врожденных дефектов и инфекционных заболеваний [2]. Помимо тяжелой задержки умственного развития эти дети имеют более короткую продолжительность жизни, а также в 10-20 раз более высокий риск развития лейкемии и ранней деменции. Наличие трисомий по 13 и 18 хромосомам также ассоциировано с развитием различных клинических патологий и высоким риском младенческой смерти [3].
Именно поэтому ученые со всего мира потратили десятки лет на изобретение технологий, позволяющих диагностировать хромосомные аномалии у детей еще на этапе ранних сроков беременности. В настоящее время существует целый ряд неинвазивных лабораторных методов, позволяющих выявить повышенный риск хромосомных аномалий у плода. Диагностическая точность (чувствительность) комбинированного скрининга, который включает в себя результаты лабораторных анализов и ультразвукового исследования, составляет 75-95% с частотой ложноположительных результатов 5-10% [4,5]. Таким образом, врачи вынуждены направлять до 30% беременных женщин на проведение дополнительного, инвазивного метода исследования, который помимо высокой чувствительности имеет и серьезные недостатки.
Инвазивные диагностические процедуры, такие как биопсия ворсин хориона и амниоцентез, имеют более высокую диагностическую ценность: точность результатов исследования варьируется в пределах от 97,5% до 99,8%. Однако, проведение данных инвазивных процедур всегда ассоциировано с риском невынашивания беременности [6].
В 1969 году исследователи сделали настоящее открытие: они впервые заявили о том, что в крови матери циркулируют клетки плода, которые теоретически можно выделить и проанализировать на наличие хромосомных патологий [7]. Новых подход произвел настоящую революцию в генетической диагностике. В крови матери было выделено несколько типов клеток плода, включая трофобласт, лимфоциты, гранулоциты, ядерные эритроциты и тромбоциты.
Первые попытки определения анеуплодий и трисомий путем выделения из крови матери и анализа клеток плода были проведены методом флуоресцентной гибридизации in situ [8]. Однако, данный метод имел свои ограничения и не позволял проводить точный анализ при наличии небольшого количества выделенных фетальных клеток. На смену этому методу пришел более новый: Lo et al. (1997) выявили, что в крови матери возможно определение внеклеточной ДНК плода, концентрация которой достигает поразительно высоких значений в 3,4-6,2%, что в 20-25 раз выше концентрации клеточных фракций плода в крови матери [9,10]. Кроме того, обнаружить фетальную ДНК возможно в даже небольшом объеме крови матери: достаточно образца объемом всего 10 мл [10]. Данное открытие произвело настоящую революцию в медицине и привело к открытию и массовому использованию новейшего, уникального диагностического метода — неинвазивного пренатального тестирования.
Неинвазивное пренатальное тестирование — прорыв в области диагностики хромосомных аномалий плода
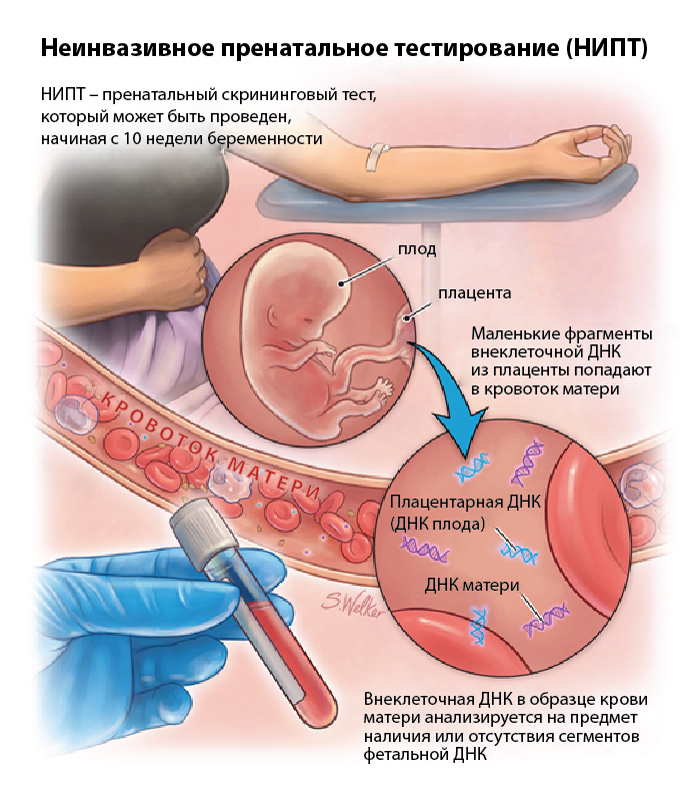 Неинвазивное пренатальное тестирование (НИПТ; Non-Invasive Prenatal Testing, NIPT) — представляет собой новейшую методику выявления и анализа внеклеточной ДНК плода, циркулирующей в крови беременной женщины, с целью скрининга и выявления трисомии по 21 хромосоме (синдром Дауна), 13 хромосоме (синдром Патау) и 18 хромосоме (синдром Эдвардса), а также других генетических аномалий.
Неинвазивное пренатальное тестирование (НИПТ; Non-Invasive Prenatal Testing, NIPT) — представляет собой новейшую методику выявления и анализа внеклеточной ДНК плода, циркулирующей в крови беременной женщины, с целью скрининга и выявления трисомии по 21 хромосоме (синдром Дауна), 13 хромосоме (синдром Патау) и 18 хромосоме (синдром Эдвардса), а также других генетических аномалий.
Впервые данный метод был применен на практике с целью скрининга на наличие синдрома Дауна в 2011 году: тогда исследователи продемонстрировали, что чувствительность НИПТ достигает 99%, а частота ложноположительных результатов не превышает 0,1% [11]. Данные исследования не могли не внушить позитивные ожидания относительно будущего развития нового направления диагностики.
В период с марта 2012 года по апрель 2013 года было проведено масштабное международное исследование, в которое было включено 15841 беременных женщин в возрасте от 18 до 48 лет на сроке гестации от 10 до 14 недель . Всем пациенткам выполнили стандартный комбинированный скрининг (определение маркеров и УЗИ), а также НИПТ с целью диагностики трисомий по 21, 18 и 13 хромосомам. Кроме того, авторы проанализировали диагностическую ценность НИПТ у пациенток в возрасте до 35 лет, у которых риск трисомии 21 по результатам стандартного скрининга был менее 1:270 (низкая группа риска) [12].
Среди 15841 беременностей в 68 из них у плода имелись хромосомные аномалии (в 1 беременности из 236). Из них: 38 трисомий 21, 10 трисомий 18, 6 трисомий 13 и 3 случая 45,X, 3 маркерных хромосомы, 2 сбалансированные транслокации, 2 несбалансированные транслокации, 1 делеция 7p, 1 делеция/удвоение 5p, 1 1q41 делеция и 1 изохромосома Yp [12].
Результаты НИПТ при скрининге на выявление трисомии по 21 хромосоме [12]
| Переменная | Стандартный скрининг | НИПТ | ||
|---|---|---|---|---|
| Все пациенты (n = 15841) | Все пациенты (n = 15841) | Пациенты в возрасте до 35 лет (n = 11994) | Пациенты низкой группы риска (n = 14957) | |
| Истинно положительный результат | 30 | 38 | 19 | 8 |
| Истинно отрицательный результат | 14949 | 15794 | 11969 | 14941 |
| Ложно положительный результат | 854 | 9 | 6 | 8 |
| Ложно отрицательный результат | 8 | 0 | 0 | 0 |
| Чувствительность (95% ДИ), % | 78,9 (62,7-90,4) |
100 (90,4-100) |
100 (82,4-100) |
100 (63,1-100) |
| Специфичность (95% ДИ), % | 94,6 (94,2-94,9) |
99,9 (99,9-100)* |
99,9 (99,9-100) |
99,9 (99,9-100) |
| Прогностическая ценность положительного результата (95% ДИ), % | 3,4 (2,3-4,8) |
80,9 (66,7-90,9)* |
76,0 (54,9-90,6) |
50 (24,7-75,3) |
| Прогностическая ценность отрицательного результата (95% ДИ), % | 99,9 (99,9-100) |
100 (99,9-100)† |
100 (99,9-100) |
100 (99,9-100) |
* — p < 0,001 (при сравнении результатов НИПТ с результатами стандартного скрининга);
† — p < 0,005 (при сравнении результатов НИПТ с результатами стандартного скрининга)
НИПТ позволил диагностировать все 38 случаев трисомии 21 (чувствительность метода 100%, 95% доверительный интервал [ДИ] = 90,7-100; p = 0,008). При этом при проведении стандартного скрининга удалось обнаружить только 30 случаев трисомии 21 из 38 (чувствительность метода 78,9%, 95% ДИ = 62,7-90,4; p = 0,008). Частота ложноположительных результатов по результатам стандартного скрининга составила 5,4% (854 ложноположительных результата на 15841 беременностей; 95% ДИ = 5,1-5,8; p < 0,001), а аналогичный показатель для НИПТ был всего 0,06% (ДИ = 0,03-0,11). Прогностическая ценность положительного результата НИПТ достигла 80,9% (95% ДИ = 66,7-90,9) и статистически значимо (p < 0,001) превысила таковую в стандартном комбинированном скрининге (3,4%; 95% ДИ = 2,3-4,8) [12]. Высокая чувствительность НИПТ в отношении диагностики синдрома Дауна была подтверждена и в ряде других исследований.
Среди 11994 женщин низкой группы риска в возрасте до 35 лет, НИПТ позволил выявить 19 из 19 случаев трисомии 21, количество случаев ложноположительных результатов составило 6. Среди 14957 женщин, у которых риск трисомии 21 по результатам стандартного скрининга был менее 1:270, НИПТ обнаружил все 8 из 8 случаев тримосии 21 [12].
В 10 беременностях из 15841 у плода была трисомия 18. Посредством НИПТ авторы диагностировали 9 случаев из 10 (с 1 ложноположительным результатом), а посредством стандартного скрининга — 8 случаев (с 49 ложноположительными результатами). Прогностическая ценность положительного результата НИПТ достигла 90,0% (95% ДИ = 55,5-99,7) и статистически значимо (p < 0,001) превысила таковую в стандартном комбинированном скрининге (14,0%; 95% ДИ = 6,3-25,8) [12].
НИПТ позволил выявить 2 случая из 2 тримосии 13, при этом в результате стандартного скрининга был обнаружен только 1 случай. Количество ложноположительных результатов при НИПТ составило 1 (0,02%; 95% ДИ = 0-0,06), а при стандартном скрининге — 28 (0,25%; 95% ДИ = 0,17-0,36), различие было статистически значимым (p < 0,001) [12].
Таким образом, в случае диагностирования высокого риска наличия хромосомной патологии, пациенткам рекомендуется проведение инвазивных диагностических исследований для точного анализа хромосомного набора плода.
Инвазивные диагностические методы
Биопсия ворсин хориона, которая проводится на сроке 10-12 недель гестации, позволяет получить ткань плаценты и проанализировать точный хромосомный набор плода для выявления генетических аномалий. Биопсия ворсин хориона может производиться как трансабдоминально, так и трансцервикально. Если срок беременности превышает 15 недель, то возможно проведение другого инвазивного исследования — амниоцентеза, когда выполняется пункция амниотической оболочки с целью получения околоплодных вод для последующего лабораторного исследования.
Когда рекомендуется проведение инвазивного диагностического исследования:
- Аномальные результаты скрининга 1 или 2 триместра
- Наличие хромосомной аномалии плода в предыдущей беременности
- Семейный анамнез генетических заболеваний
- Если мать или отец ребенка являются носителем генетического заболевания
- Возраст женщины более 35 лет
Научный прорыв в области диагностики хромосомных аномалий плода
Несомненный плюс инвазивных диагностических тестов — возможность получить генетический материал плода и сказать со 100% уверенностью о наличии или отсутствии хромосомной патологии у ребенка. Но данные методы имеют и свою обратную сторону: риск самопроизвольного аборта после таких инвазивных процедур колеблется в пределах от 0,1% до 1%. Несмотря на то, что данный процент кажется довольно маленьким, давайте задумаемся: имеем ли мы право рисковать 1 беременностью из 100? И стоит ли игра свеч? Как мы отметили выше, инвазивное диагностическое исследование особо рекомендуется женщинам старшего репродуктивного возраста. Известно, что с возрастом у человека накапливаются генетические мутации, таким образом, риск рождения ребенка с генетическими аномалиями прогрессивно возрастает уже после 35 лет, а в возрасте 40-44 года риск рождения ребенка с синдромом Дауна составляет 1:66.
Но кто, как правило, решается на беременность после 40 лет? Чаще всего это пациентки, которые долго не могли заполучить беременность естественным путем. Таким образом, значительную долю беременных женщин после 40 лет составляют пациентки, которые в течение очень продолжительного времени лечились от первичного или вторичного бесплодия и наконец-то заполучили пусть и позднюю, но такую долгожданную беременность в результате применения вспомогательных репродуктивных технологий (ВРТ). Имеем ли мы моральное право подвергать данных пациенток риску самопроизвольного аборта? Пожалуй, это риторический вопрос. Но здесь совсем недавно на помощь врачу акушеру-гинекологу пришел новейший инновационный метод — неинвазивное пренатальное тестирование (НИПТ), точность которого достигает 99,9%.
НИПТ в России
Такие воодушевляющие результаты исследования навели авторов на мысль о возможности повсеместного использования НИПТ в качестве стандартного скрининга всех беременных женщин. И пока в Великобритании проходят интенсивные дебаты по этому вопросу, метод НИПТ только недавно «добрался» до России, но уже заслужил большое доверие со стороны всех акушеров-гинекологов и врачей-генетиков, которые с ним столкнулись. К сожалению, стоимость данного анализа достаточно высока (порядка 30-35 тысяч рублей в зависимости от лаборатории), но есть и обратная сторона вопроса. Как известно, самый высокий риск рождения ребенка с хромосомными аномалиями имеют женщины старшего репродуктивного возраста: в возрасте 35-39 лет данный риск составляет 1:212, а в возрасте 40-44 уже достигает 1:66. Как правило, на беременность в таком возрасте решаются пациентки, которые уже очень долго не могли забеременеть или, возможно, забеременели посредством далеко не первой попытки ЭКО (это же относится и к более молодым пациенткам). При обнаружении высокого риска хромосомной аномалии плода по результатам стандартного комбинированного скрининга врач акушер-гинеколог вынужден направлять таких пациенток на инвазивные диагностические процедуры, подвергая их высокому риску самопроизвольного прерывания (до 1%) столь долгожданной беременности.
Имеем ли мы моральное право подвергать этих пациенток такому высокому риску, и оправдан ли он? Мировое медицинское сообщество постепенно приходит к выводу, что, возможно, НИПТ — это как раз тот самый «спасательный круг», который поможет избежать проведения ненужных инвазивных процедур и сохранит столь ценную 1 беременность из 100.
Города и адреса лабораторий в РФ, где можно провести НИПТ
Список использованной литературы
- Lejeune J., Gautier M., Turpin R. Etude des chromosomes somatiques de neuf enfants mongoliens // C R Hebd Seances Acad Sci. 1959. Vol. 248. P. 1721–1722.
- Gardner R.J.M., Sutherland G.R., Shaffer L.G. Chromosome Abnormalities and Genetic Counseling // -Oxf. Univ. Press. 2012. P. 634.
- Menasha J. et al. Incidence and spectrum of chromosome abnormalities in spontaneous abortions: new insights from a 12-year study // Genet Med. 2005. Vol. 7. P. 251–263.
- ACOG Committee on Practice Bulletins, authors. ACOG Practice Bulletin No. 77: screening for fetal chromosomal abnormalities // Obstet Gynecol. 2007. Vol. 109. P. 217–227.
- Driscoll D.A., Gross S.J. Screening for fetal aneuploidy and neural tube defects // Genet Med. 2009. Vol. 11. P. 818–821.
- Lippman A. et al. Canadian multicentre randomized clinical trial of chorion villus sampling and amniocentesis. Final report. // Prenat Diagn. 1992. Vol. 12. P. 385–408.
- Walknowska J., Conte F.A., Grumbach M.M. Practical and theoretical implications of fetal-maternal lymphocyte transfer // Lancet. 1969. Vol. 1. P. 1119–1122.
- Elias S. et al. First trimester prenatal diagnosis of trisomy 21 in fetal cells from maternal blood // Lancet. 1992. Vol. 340. P. 1033.
- Lo Y.M. et al. Presence of fetal DNA in maternal plasma and serum // Lancet. 1997. Vol. 350. P. 485–487.
- Lo D. et al. Quantitative analysis of fetal DNA in maternal plasma and serum: implications for noninvasive prenatal diagnosis // Am J Hum Genet. 1998. Vol. 62. P. 768–775.
- Gil M.M. et al. Analysis of cell-free DNA in maternal blood in screening for fetal aneuploidies: updated meta-analysis // Ultrasound Obstet. Gynecol. 2015. Vol. 45, № 3. P. 249–266.
- Norton M.E. et al. Cell-free DNA Analysis for Noninvasive Examination of Trisomy // N Engl J Med. 2015. Vol. 372. P. 1589–1597.